| Гидразин | |
|---|---|
 | |
 | |
 | |
| Общие | |
| Систематическое наименование |
Гидразин |
| Хим. формула | N2H4 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 32,05 г/моль |
| Плотность | 1,01 г/см³ |
| Энергия ионизации | 8,93 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | +2 °C |
| Т. кип. | 114 °C |
| Т. всп. | 99 ± 1 градус Фаренгейта[1] |
| Пр. взрв. | 2,9 ± 0,1 об.%[1] |
| Давление пара | 10 ± 1 мм рт.ст.[1] |
| Химические свойства | |
| pKa | 8,1 ± 0,01[2] |
| Растворимость в воде | смешивается |
| Классификация | |
| Рег. номер CAS | [302-01-2] |
| PubChem | 9321 |
| Рег. номер EINECS | 206-114-9 |
| SMILES | |
| InChI | |
| RTECS | MU7175000 |
| ChEBI | 15571 |
| Номер ООН | 2029 |
| ChemSpider | 8960 |
| Безопасность | |
| Пиктограммы СГС |
     |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
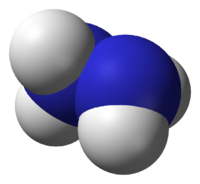
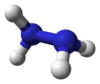
Гидрази́н (диамид) H2N—NH2 — бесцветная, очень токсичная, сильно гигроскопическая жидкость, с неприятным запахом.
Молекула N2H4 состоит из двух групп NH2, повёрнутых друг относительно друга, что обусловливает полярность молекулы гидразина, μ = 0,62⋅10−29 Кл · м. Смешивается в любых соотношениях с водой, жидким аммиаком, этанолом; в неполярных растворителях растворяется плохо. Образует органические производные: алкилгидразины и арилгидразины.
Был открыт в 1887 году Теодором Курциусом[3].
Свойства
Термодинамически гидразин значительно менее устойчив, чем аммиак, так как связь N—N не очень прочна: разложение гидразина — экзотермическая реакция, протекающая в отсутствие катализаторов при 200—300 °С:
Переходные металлы (Co, Ni, Cu, Ag) катализируют разложение гидразина. При катализе платиной, родием и палладием основными продуктами разложения являются азот и водород:
Благодаря наличию двух неподелённых пар электронов у атомов азота, гидразин способен к присоединению одного или двух ионов водорода. При присоединении одного протона получаются соединения гидразиния с зарядом 1+, двух протонов — гидразония с зарядом 2+, содержащие соответственно ионы N2H5+ и N2H62+. Водные растворы гидразина обладают основными свойствами, но его основность значительно меньше, чем у аммиака:
(для аммиака Kb = 1,78⋅10−5)
Протонирование второй неподеленной пары электронов протекает ещё труднее:
Известны соли гидразина — хлорид гидразиния N2H5Cl, сульфат гидразиния N2H6SO4 и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4 · H2SO4 и т. д. и называют гидрохлорид гидразина, сульфат гидразина и т. д. Большинство таких солей растворимо в воде.
Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N2H4 · H2SO4.
Гидразин как восстановитель
Гидразин — энергичный восстановитель. В растворах гидразин обычно также окисляется до азота:
Восстановить гидразин до аммиака можно только сильными восстановителями, такими, как Sn2+, Ti3+, водородом в момент выделения (Zn + HCl):
Окисляется кислородом воздуха до азота, аммиака и воды. Известны многие органические производные гидразина. Гидразин, а также гидразин-гидрат, гидразин-сульфат, гидразин-хлорид, широко применяются в качестве восстановителей золота, серебра, платиновых металлов из разбавленных растворов их солей. Медь в аналогичных условиях восстанавливается до закиси.
В органическом синтезе гидразин применяется для восстановления карбонильной группы альдегидов и кетонов до метиленовой по Кижнеру—Вольфу (реакция Кижнера—Вольфа), реакция идёт через образование гидразонов, расщепляющихся затем под действием сильных оснований.
Обнаружение
Качественной реакцией на гидразин служит образование окрашенных гидразонов с некоторыми альдегидами, в частности — с p-диметиламинобензальдегидом.
Получение
Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO[4] (метод Рашига):
реакция проводится при температуре 160 °C и давлении 2,5−3,0 МПа.
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
реакция проводится при температуре ~100 °C и атмосферном давлении.
Применяется также метод Байера:
Применение
Гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива.
Гидразина сульфат применяется в случае таких заболеваний, как неоперабельные прогрессирующие распространенные формы, рецидивы и метастазы злокачественных опухолей — рак лёгкого (особенно немелкоклеточный), молочных желез, желудка, поджелудочной железы, гортани, эндометрия, шейки матки, десмоидный рак, саркома мягких тканей, фибросаркома, нейробластома, лимфогранулематоз, лимфосаркома (монотерапия или в составе полихимиотерапии).
Гидразин также применяется в качестве топлива в гидразин-воздушных низкотемпературных топливных элементах.
Жидкая смесь гидразина и нитрата аммония используется как мощное взрывчатое средство с нулевым кислородным балансом — астролита, который, однако, в настоящее время практического значения не имеет.
Гидразин широко применяется в химической промышленности в качестве восстановителя кислорода, содержащегося в деминерализованной воде, применяемой для питания котлов (котельные установки, производства аммиака, слабой азотной кислоты и другое). При этом протекает следующая химическая реакция:
N2H4 + O2 = N2 + 2H2O.
Ракетное топливо
Во время Второй мировой войны гидразин применялся в Германии в качестве одного из компонентов топлива для реактивных истребителей «Мессершмитт Ме-163» (C-Stoff, содержащий до 30 % гидрата гидразина).
Гидразин и его производные (метилгидразин, несимметричный диметилгидразин и их смеси (аэрозин)) широко распространены как ракетное горючее. Они могут быть использованы в паре с самыми разными окислителями, а некоторые и в качестве однокомпонентного топлива, в этом случае рабочим телом двигателя являются продукты разложения на катализаторе. Последнее удобно для маломощных двигателей.
| Окислитель | Удельная тяга (Р1, с*) | Температура сгорания °С | Плотность топлива г/см³ | Прирост скорости, ΔVид, 25, м/с | Весовое содержание горючего % |
|---|---|---|---|---|---|
| Фтор | 364,4 с | °С | 1,314 | 5197 м/с | 31 % |
| Тетрафторгидразин | 334,7 с | °С | 1,105 | 4346 м/с | 23,5 % |
| ClF3 | 294,6 с | °С | 1,507 | 4509 м/с | 27 % |
| ClF5 | 312,0 с | °С | 1,458 | 4697 м/с | 26,93 % |
| Перхлорилфторид | 295,3 с | °С | 1,327 | 4233 м/с | 40 % |
| Фторид кислорода | 345,9 с | °С | 1,263 | 4830 м/с | 40 % |
| Кислород | 312,9 с | °С | 1,065 | 3980 м/с | 52 % |
| Пероксид водорода | 286,9 с | °С | 1,261 | 4003 м/с | 33 % |
| N2O4 | 291,1 с | °С | 1,217 | 3985 м/с | 43 % |
| Азотная кислота | 279,1 с | °С | 1,254 | 3883 м/с | 40 % |
- Удельная тяга равна отношению тяги к весовому расходу топлива; в этом случае она измеряется в секундах (с = Н·с/Н = кгс·с/кгс). Для перевода весовой удельной тяги в массовую её надо умножить на ускорение свободного падения (примерно равное 9,81 м/с²). В ракетно-космической сфере для обозначения чаще используют термин «удельный импульс тяги» (выражаемый в м/с) или просто «удельный импульс» (в секундах). Выраженная в м/с, эта величина характеризует скорость истечения реактивной струи (приблизительно, с учетом дополнительного слагаемого в формуле тяги ЖРД). Удельный импульс является важнейшей характеристикой совершенства ракетных двигателей. Зависит от типа применяемой топливной пары, схемы и конструкции двигателя и других параметров.
Токсичность
Гидразин и большинство его производных очень токсичны. Небольшие концентрации гидразина вызывают раздражение глаз, дыхательных путей. При повышении концентрации начинается головокружение, головная боль и тошнота. Далее следуют судороги, токсический отёк лёгких, а за ними — кома и смерть. ПДК в воздухе рабочей зоны = 0,1 мг/м3. Относится к первому классу опасности[5].
Примечания
- 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0329.html
- ↑ Hall H. K. Correlation of the Base Strengths of Amines 1 // J. Am. Chem. Soc. / P. J. Stang — American Chemical Society, 1957. — Vol. 79, Iss. 20. — P. 5441–5444. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA01577A030
- ↑ Волков В. А., Вонский Е. В., Кузнецова Г. И. Выдающиеся химики мира. — М: ВШ, 1991. — С. 656.
- ↑ Третьяков и др., 2001.
- ↑ Гидразин-гидрат технический
Литература
- Ахметов Н. С. Общая и неорганическая химия. — 4-е изд., испр. — М.: Высшая школа, 2003. — 743 с. — ISBN 5-06-003363-5.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Учебное пособие для вузов. — 4-е изд., стер. — М.: Химия, 2000. — 592 с., ил. — ISBN 5-7245-1130-4; ББК 540 К 21; УДК 546(075.8).
- Третьяков Ю. Д. и др. 15.3.3.1. Водородные соединения азота и их производные. Гидразин. Гидроксиламин. // Неорганическая химия. Химия элементов: Учебник для вузов. В 2 книгах. Кн. II / Ю. Д. Третьяков, Л. И. Мартыненко, А. Н. Григорьев, А. Ю. Цивадзе. — М.: Химия, 2001. — С. 869-872. — 583 с., ил. — ISBN 5-7245-1214-9; ББК 24.1 (я 7); УДК 546 Т 66.
- Одрит Л., Огг Б. Химия гидразина = The Chemistry of Hydrazine. — М.: ИИЛ, 1954. — 238 с., ил.
Данная страница на сайте WikiSort.ru содержит текст со страницы сайта "Википедия".
Если Вы хотите её отредактировать, то можете сделать это на странице редактирования в Википедии.
Если сделанные Вами правки не будут кем-нибудь удалены, то через несколько дней они появятся на сайте WikiSort.ru .



![{\mathsf {N_{2}H_{4}+H_{2}O\rightarrow [N_{2}H_{5}]^{+}+OH^{-},\ \ K_{b}=3,0\cdot 10^{{-6}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2164eb977387c5f2c6a50a6d75281049797f2ad9)
![{\mathsf {[N_{2}H_{5}]^{+}+H_{2}O\rightarrow [N_{2}H_{6}]^{{2+}}+OH^{-},\ \ K_{b}=8,4\cdot 10^{{-16}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d91d285b534baf11705193200d666ecec7936e6)
![{\mathsf {N_{2}H_{4}+HCl\rightarrow [N_{2}H_{5}]Cl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e651fce609d9b1f336bf14b53c3607710a0c081c)





